Situation bei Jungen und Männern
Autor: Dr. med. Gesche Riabowol (geb. Tallen), Maria Yiallouros, Redaktion: Maria Yiallouros, Freigabe: Prof. Dr. med. Anja Borgmann-Staudt, Prof. Dr. med. Thorsten Langer, Zuletzt geändert: 05.08.2025 https://kinderkrebsinfo.de/doi/e150455
Inhaltsverzeichnis
- Fortpflanzungsorgane und Fruchtbarkeit
- Mögliche Spätfolgen – Krankheitsbilder und Symptome
- Risikofaktoren für eine Beeinträchtigung der Fruchtbarkeit
- Empfehlungen für die Nachsorge
- Vorbeugende Maßnahmen zur Erhaltung der Fruchtbarkeit vor Therapiebeginn
- Behandlung von Fruchtbarkeitsstörungen und Hormonmangel nach der Therapie
Fortpflanzungsorgane und Fruchtbarkeit
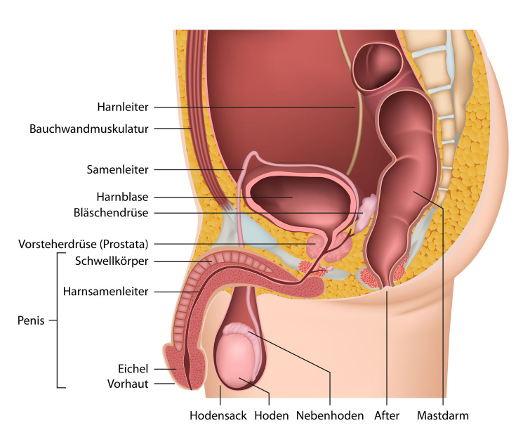
Zu den Fortpflanzungsorganen eines Jungen beziehungsweise Mannes gehören unter anderem Penis und Hodensack (äußere Geschlechtsorgane) sowie die paarig angelegten Hoden und Nebenhoden, die beiden Samenleiter, die Vorsteherdrüse (Prostata) und die Bläschendrüsen (innere Geschlechtsorgane). Die männlichen Geschlechtsorgane sind die Grundlage dafür, dass Männer Kinder zeugen können.
Mit Beginn der Pubertät werden in den Hoden die männlichen Keimzellen, die Samenzellen (Spermien), gebildet. Darüber hinaus produzieren sie auch das männliche Geschlechtshormon Testosteron. Der Zeitpunkt, an dem ein Junge zum ersten Mal Spermien bildet, wird auch als Spermarche bezeichnet.
Spermienbildung
Die Samenzellbildung erfolgt ab der Spermarche kontinuierlich in den zahlreichen, vielfach gewundenen Samenkanälchen der Hoden (auch Hodenkanälchen genannt). Von dort wandern die Spermien zu den Nebenhoden, wo sie weiter reifen und zwischengespeichert werden. Bis aus einer Urkeimzelle ein reifes Spermium entsteht, vergehen durchschnittlich etwa drei Monate.
Bei einem Samenerguss (Ejakulation) werden die Spermien aus den Nebenhoden über die Samenleiter in die Harnröhre transportiert. Die Prostata und die Bläschendrüsen sondern dabei eine Flüssigkeit ab, die unter anderem die Beweglichkeit der Spermien ermöglicht. Besondere Blutgefäße im Penis, die so genannten Schwellkörper, sorgen dafür, dass dieser sich vor einem Samenerguss aufrichtet (Erektion).
Bei einer Ejakulation während des Geschlechtsverkehrs gelangt die Samenflüssigkeit durch die Harnröhre in die weibliche Scheide. Ein Milliliter Sperma kann bis zu 100 Millionen Spermien enthalten. Eine Schwangerschaft entsteht, wenn eine Eizelle auf ihrem Weg aus dem Eileiter in die Gebärmutter von einer Samenzelle befruchtet wird und sich anschließend in die Gebärmutterschleimhaut einnistet (siehe Situation beim Mädchen und bei der Frau). Samenzellen überleben zwei bis drei Tage in der Scheide, in der Gebärmutter und im Eileiter einer Frau.
Testosteronproduktion
Testosteron ist ein wichtiges männliches Sexualhormon. Es wird vor allem in den Hoden von den so genannten Leydigzellen gebildet und ist unter anderem dafür verantwortlich, dass in der Pubertät die männlichen Geschlechtsorgane (Hoden, Penis) wachsen und die Spermien reifen.
Darüber hinaus fördert Testosteron die Ausbildung (und Aufrechterhaltung) der typischen männlichen Geschlechtsmerkmale (wie Körperbehaarung, Bartwuchs, Stimmbruch / tiefe Stimme, verstärkter Muskelaufbau, Hervortreten des Kehlkopfes), die nach außen den Eintritt der Geschlechtsreife signalisieren. Sie werden auch als „sekundäre Geschlechtsmerkmale“ bezeichnet. Testosteron wirkt außerdem auf den Stoffwechsel (zum Beispiel den Fett- und Zuckerstoffwechsel) und die Knochenbildung ein und beeinflusst das Wohlbefinden. So kann ein Mangel an Testosteron zum Beispiel zu depressiven Verstimmungen führen.
Gut zu wissen: Die männlichen Geschlechtsmerkmale (insbesondere Hodenvolumen und Schamhaarentwicklung) spielen bei der diagnostischen Beurteilung der Pubertätsentwicklung als Gradmesser der Geschlechtsreife eine wichtige Rolle. Die verschiedenen Entwicklungsschritte während der Pubertät werden mit Hilfe der so genannten Tanner-Stadien (Tanner-Klassifikation) unterschieden.
Regelkreis der Sexualhormone
Die Hodenfunktion steht unter dem Einfluss von Geschlechtshormonen, die von Drüsen im Gehirn (Hypothalamus, Hypophyse) freigesetzt werden: Auf höchster Ebene schüttet der Hypothalamus das so genannte gonadotropinfreisetzende Hormon (GnRH) aus. Dieses Hormon veranlasst wiederum die Hirnanhangsdrüse (Hypophyse) dazu, Follikel-stimulierendes Hormon (FSH) und luteinisierendes Hormon (LH) abzugeben. Über den Blutkreislauf gelangen FSH und LH zu den Hoden, wo sie die Sertoli-Zellen zur Entwicklung der Samenzellen und die Leydig-Zellen zur Testosteronausschüttung anregen. Die Fruchtbarkeit eines Mannes ist somit nicht nur von der Gesundheit und Funktionsfähigkeit der Geschlechtsorgane selbst abhängig, sondern setzt ein störungsfreies Zusammenspiel verschiedener Körperorgane und ihrer Hormonfunktionen voraus.
Was bedeutet Fruchtbarkeit?
Für einen Mann bedeutet Fruchtbarkeit, dass er eigene Kinder zeugen kann. Die Zeugungsfähigkeit beginnt in der Pubertät im Prinzip ab dem ersten Samenerguss und kann bis ins hohe Alter andauern. Allerdings nehmen mit zunehmendem Alter die Spermienqualität und somit die Fruchtbarkeit ab.
Mögliche Spätfolgen – Krankheitsbilder und Symptome
Eine Krebsbehandlung kann bei Jungen auf unterschiedliche Weise die Fruchtbarkeit beeinflussen oder beeinträchtigen. Abgesehen von der Art und Intensität der Behandlung spielt dabei insbesondere das Alter der Patienten zum Zeitpunkt der Behandlung eine Rolle. Prinzipiell scheinen Chemotherapie wie auch Strahlentherapie vor Eintritt der Pubertät weniger schädigend zu sein als nach Eintritt der Pubertät.
Im Anschluss erhalten Sie Informationen zu den möglichen Spätfolgen, die eine Krebstherapie auf die Geschlechtsentwicklung und Fruchtbarkeit eines Jungen / eines Mannes haben kann.
Ausbleibende, verzögerte oder unvollständige Pubertätsentwicklung
Jungen, die vor Beginn oder während der Pubertät im Bereich von Hypothalamus und/oder Hirnanhangsdrüse (Hypophyse) operiert oder bestrahlt oder mit bestimmten Dosierungen von Platinsubstanzen und/oder Alkylanzien behandelt wurden, haben ein erhöhtes Risiko, dass die Pubertät bei ihnen gar nicht, unvollständig oder verzögert eintritt.
Von einer verzögerten Pubertätsentwicklung (Pubertas tarda) kann man ausgehen, wenn bei einem Jungen im Alter von 14 Jahren noch keine Pubertätszeichen (wie Hoden- und Peniswachstum, Schamhaarentwicklung) vorhanden sind, eine begonnene Pubertätsentwicklung länger als 18 Monate stillsteht oder die Entwicklung länger dauert als üblich [HAU2021a].
Vorzeitige oder beschleunigte Pubertätsentwicklung
Nach einer Schädelbestrahlung kann es, aufgrund einer Schädigung von Nervenzellen im Gehirn (Hypothalamus), zu einer frühzeitigen oder beschleunigten Pubertätsentwicklung kommen (Pubertas praecox). „Frühzeitig“ bedeutet bei einem Jungen, dass sich die ersten Pubertätszeichen, also die Veränderung der äußeren und inneren Geschlechtsmerkmale, bereits vor dem neunten Geburtstag bemerkbar machen.
Äußerlich erkennbar ist eine Pubertas praecox bei Jungen unter anderem durch eine vorzeitige Schambehaarung, verfrühten Bartwuchs und/oder ein frühzeitiges Wachsen von Hoden und Penis. Die Pubertas praecox geht zunächst auch mit einem beschleunigten Längenwachstum einher, kann letztlich aber zu einem vorzeitigen Wachstumsstopp führen (siehe auch Kapitel „Behandlung von Fruchtbarkeitsstörungen nach der Therapie“).
Testosteron-Mangel
Bestimmte Krebsbehandlungen (insbesondere eine Hodenentfernung oder -bestrahlung sowie eine Bestrahlung von Hypothalamus und/oder Hypophyse) können dazu führen, dass die Hoden nicht genügend oder gar kein männliches Geschlechtshormon (Testosteron) mehr bilden.
Ein behandlungsbedingter Testosteron-Mangel vor oder während der Pubertät kann sich dadurch bemerkbar machen, dass die Ausbildung der männlichen Geschlechtsorgane und -merkmale sowie die Entwicklung der Geschlechtsreife ausbleiben, zum Stillstand kommen oder auf andere Weise beeinträchtigt sind (siehe Kapitel „Fortpflanzungsorgane und Fruchtbarkeit“).
Bei Jungen oder jungen Männern, die erst nach Abschluss der Pubertätsphase von einem behandlungsbedingten Testosteron-Mangel betroffen sind, kann es unter anderem zu Muskelschwäche, Gewichtszunahme, erhöhter Knochenbrüchigkeit, verminderter Spermienzahl und Störungen beim Geschlechtsverkehr (Erektionsstörungen) kommen.
Unfruchtbarkeit durch beeinträchtigte Spermienproduktion
Ehemalige Patienten, bei denen im Rahmen der Behandlung beide Hoden entfernt wurden, können keine Samenzellen (Spermien) mehr bilden. Sie sind somit lebenslang unfruchtbar. Auch nach einer Chemotherapie oder Strahlentherapie kann die Spermienbildung in den Hoden beeinträchtigt sein. Dies kann dazu führen, dass sich in der Samenflüssigkeit (Ejakulat) weniger Samenzellen (Oligozoospermie) oder gar keine Samenzellen (Azoospermie) befinden. Außerdem können Form und Beweglichkeit der Spermien eingeschränkt sein.
In besonders hohem Maße betroffen von solchen Störungen sind ehemalige Patienten, die eine Stammzelltransplantation (SZT) nach vorhergehender Hochdosis-Chemotherapie und Ganzkörperbestrahlung erhalten haben. Aber auch eine intensive Standard-Chemotherapie mit bestimmten Zytostatika sowie eine Bestrahlung im Beckenbereich gehen mit einem Risiko für eine spätere Beeinträchtigung der Fruchtbarkeit infolge gestörter Spermienbildung einher.
Diese Beeinträchtigungen müssen jedoch nicht ein Leben lang anhalten. Prinzipiell kann das Hodengewebe auch Monate bis Jahre nach Therapieende wieder mit der Samenzellproduktion beginnen und die Fruchtbarkeit somit wiederhergestellt werden.
Gut zu wissen: Wenn infolge einer Krebsbehandlung die Gefahr besteht, dass sich die Samenzellproduktion nicht mehr erholt, kann es sinnvoll sein, vor Beginn der Therapie Samenzellen zu gewinnen und für einen eventuellen späteren Kinderwunsch einzufrieren (siehe Kapitel „Vorbeugende Maßnahmen zur Erhaltung der Fruchtbarkeit vor Therapiebeginn“).
Störungen der Geschlechtsfunktionen (Erektion / Ejakulation)
Durch Operationen im Bereich des Beckens oder der unteren Wirbelsäule können Nerven geschädigt werden, die den Samenerguss (Ejakulation) herbeiführen. Auch andere chirurgische Eingriffe, beispielsweise die Entfernung der Prostata oder der Blase, können Störungen bei der Ejakulation sowie Erektion verursachen. Jungen, bei denen solche Therapieverfahren angezeigt sind, werden heute vor und/oder nach der Krebsbehandlung bestimmte Maßnahmen angeboten, mit denen die Fruchtbarkeit bewahrt beziehungsweise ein späterer Kinderwunsch unterstützt werden kann (siehe unten).
Risikofaktoren für eine Beeinträchtigung der Fruchtbarkeit
Die Risikofaktoren für eine Störung der Fruchtbarkeit nach einer Krebsbehandlung werden seit vielen Jahren erforscht. Da die Behandlung aus mehreren Komponenten besteht und jeder Patient anders auf die verschiedenen Therapieformen und Medikamente reagiert, ist es schwierig, eindeutig festzustellen, welcher Therapiebestandteil in welcher Dosierung die Fruchtbarkeit schädigt.
Man weiß allerdings, dass verschiedene Behandlungen mit einem unterschiedlich hohen Risiko einer Fruchtbarkeitsschädigung einhergehen. Eine möglichst genaue Risikobewertung vor Behandlungsbeginn trägt dazu bei, vorbeugend verfügbare Maßnahmen zu ergreifen, die einer Beeinträchtigung der Fruchtbarkeit bestmöglich entgegenwirken. Nach Ende der Therapie sollte jeder Patient gemeinsam mit seinem Behandlungsteam erneut klären, welches individuelle Risiko für eine Fruchtbarkeitsstörung bei ihm vorliegt. Denn nur so kann eine angemessene Nachsorge eingeleitet werden.
Im Folgenden erhalten Sie einen Überblick über Behandlungen mit hohem, mittlerem und niedrigem Risiko für eine Schädigung der Fruchtbarkeit. Die aufgeführten Risikofaktoren entsprechen dem aktuellen Forschungsstand und werden regelmäßig überprüft.
Generell gilt: Ein Beginn der Krebstherapie nach Eintreten der Pubertät erhöht das Risiko einer Fruchtbarkeitsstörung zusätzlich, ebenso wie eine Operation im Bereich von Becken, Hypothalamus oder Hypophyse oder ein Hodgkin-Lymphom als Grunderkrankung [KRA2012] [LAN2025] [REI2013b] [WAS2014]. Eine Schädelbestrahlung im Bereich von Hypothalamus und Hirnanhangsdrüse (Hypophyse) mit Dosierungen ab etwa 30 Gray kann die Hormonproduktion der übergeordneten Keimdrüsen beeinträchtigen [GRE2009] [KOU2013] [PFI2014]; die fehlenden Hormone können jedoch ersetzt werden (siehe Hormonersatztherapie).
Behandlungen mit hohem Risiko
- Bestrahlung des Beckens mit einer Dosis auf die Hoden ab etwa 4 Gray (zum Beispiel bei Krebsbefall der Beckenregion) [LAN2025] [REI2013b] [WAS2014]
- Bestrahlung des ganzen Körpers ab etwa 4 Gray (im Rahmen der Konditionierungstherapie bei einer Stammzelltransplantation) [BOR2012] [WAS2014]
- Procarbazin-Behandlung in einer Dosierung ab etwa 6 g pro Quadratmeter Köperoberfläche (zum Beispiel bei einer früheren Behandlung eines Hodgkin-Lymphoms) [BRA1990] [LAN2025]
Behandlungen mit mittlerem Risiko
Ein mittleres Risiko für eine Beeinträchtigung der Fruchtbarkeit besteht bei der Behandlung mit bestimmten Zytostatika, deren Gesamt-Dosierung einen gewissen Wert überschreitet. Im Folgenden erhalten Sie einen Überblick über diese Zytostatika und die relevanten Dosierungen (angezeigt in Gramm pro Quadratmeter Körperoberfläche).
- Busulfan: bei Dosis über 0,4 g / m²
- Carboplatin: bei Dosis über 2 g / m²
- Cisplatin: bei Dosis über 0,5 g / m²
- Cyclophosphamid: bei Dosis über 10 g / m²
- Etoposid: bei Dosis über 5 g / m²
- Ifosfamid: bei Dosis über 42 g / m²
- Melphalan: bei Dosis über 0,14 bis 0,24 g / m²
- Procarbazin: bei Dosis über 3 g / m²
Wenn Sie wissen möchten, ob solche Zytostatikadosen bei Ihnen / Ihrem Kind eingesetzt wurden, wenden Sie sich am besten im Rahmen der Nachsorge an Ihr Behandlungsteam. Eine Liste der Therapieprotokolle, bei denen entsprechende Dosierungen der genannten Medikamente eingesetzt wurden, finden Sie in der Leitlinie „Fertilitätserhalt bei onkologischen Erkrankungen“ [DIT2017]. Dort erhalten Sie auch weitere Informationsquellen zu den oben genannten Zytostatikadosen.
Behandlungen mit geringem Risiko
Bei Patienten, die keine der oben genannten Behandlungen erhalten haben, besteht in aller Regel nur ein geringes Risiko für eine Beeinträchtigung der Fruchtbarkeit. In der oben genannten Leitlinie [DIT2017] finden Sie eine Liste der Therapieprotokolle mit einem niedrigen Risikopotential für Fruchtbarkeitsschädigungen.
Empfehlungen für die Nachsorge
Nach Therapieende sollten sich alle Jungen und jungen Männer zur Überwachung der Pubertäts- und Fruchtbarkeitsentwicklung auch weiterhin regelmäßig untersuchen lassen. Ein frühzeitiges Erkennen von Störungen ermöglicht den Einsatz geeigneter Behandlungsmaßnahmen (zum Beispiel eine Hormontherapie). Außerdem dienen die Nachsorgeuntersuchungen dazu, ehemalige Patienten mit Fruchtbarkeitsstörungen bei der Familienplanung zu unterstützen.
Zu den jährlich empfohlenen Nachsorgeuntersuchungen gehören die Anamnese-Erhebung, die körperliche Untersuchung und, bei Bedarf, eine Hormonanalyse. Darüber hinaus können ergänzende Untersuchungen (zum Beispiel eine Samenzellanalyse) sinnvoll sein. Die wichtigsten Nachsorgeuntersuchungen werden im Folgenden kurz vorgestellt.
Anamnese-Erhebung
Der Arzt wird sich bei dieser Untersuchung nach der Krankengeschichte (Anamnese) des ehemaligen Patienten erkundigen und dabei auch Angaben zur Hormoneinnahme beachten.
Körperliche Untersuchung
Bei der körperlichen Untersuchung achtet der Arzt auf die körperliche Entwicklung und den Pubertätsverlauf des ehemaligen Patienten. Gemessen und bewertet werden die Entwicklungsschritte während der Pubertät unter anderem mit Hilfe der so genannten Tanner-Stadien, die bei Jungen die Entwicklung der Geschlechtsorgane (Hodengröße, Penislänge) sowie äußere Geschlechtsmerkmale (wie Schambehaarung) berücksichtigen (siehe auch Abschnitt „Fortpflanzungsorgane und Fruchtbarkeit“).
Eine mangelnde Schambehaarung, fehlender oder spärlicher Bartwuchs und ein Ausbleiben des Stimmbruchs sind ein Hinweis darauf, dass zu wenig Testosteron gebildet wird. Bei einem jungen Mann besteht Verdacht auf eine Beeinträchtigung der Fruchtbarkeit, wenn das Hodenvolumen unter 12 Millimeter liegt (dies entspricht einer Hodengröße von 3 x 2 x 2 cm) [BRA2009].
Hormonanalyse
Im Rahmen der Nachsorgeuntersuchung kann anhand einer Blutentnahme auch die Konzentration der Geschlechtshormone bestimmt werden. Untersucht werden dabei die Hormone LH, FSH, Testosteron und Inhibin B. Da die Hormonwerte schwanken können (dies gilt insbesondere für die Testosteronwerte), muss bei einem auffälligen Ergebnis mindestens eine weitere Analyse erfolgen.
Wichtig: Die Einnahme von Sexualhormonen beeinflusst das Ergebnis der Analyse. Bitte teilen Sie Ihrem Arzt daher mit, ob Sie zum Zeitpunkt der Untersuchung Hormone eingenommen haben.
Samenzellanalyse
Eine Analyse der Spermien ist im Rahmen der Nachsorge nicht routinemäßig vorgesehen, sie kann aber im Einzelfall sinnvoll sein, um die Fruchtbarkeit genauer zu beurteilen. Bei der Untersuchung wird eine Samenerguss-Probe unter dem Mikroskop im Hinblick auf die Anzahl der Samenzellen, ihre Beweglichkeit und Form untersucht. Ist das Ergebnis der Untersuchung auffällig, so wird die Analyse in der Regel nach etwa zehn Wochen wiederholt, bevor weitere Maßnahmen empfohlen werden. Denn in dieser Zeit hat ein neuer Zyklus der Spermienreifung begonnen und die Störung hat sich eventuell gebessert oder ist sogar ganz behoben.
Wenn wiederholt nachgewiesen wird, dass gesunde Samenzellen im Samenerguss fehlen, besteht bei einem aktuellen Kinderwunsch in vielen Fällen die Möglichkeit, durch eine Entnahme von Hodengewebe (Hodenbiopsie) lebende Samenzellen für eine künstliche Befruchtung zu gewinnen (siehe auch Abschnitt „Behandlung von Fruchtbarkeitsstörungen nach der Therapie“). In einzelnen Fällen kann sich die Samenzellproduktion auch einige Jahre nach der Krebstherapie von selbst erholen.
Vorbeugende Maßnahmen zur Erhaltung der Fruchtbarkeit vor Therapiebeginn
Umfragen gemäß haben viele ehemalige Patienten einen Kinderwunsch. Die behandelnden Ärzte streben deshalb an, das Risiko einer Unfruchtbarkeit so gering wie möglich zu halten. Bereits vor einer Krebsbehandlung können fruchtbarkeitserhaltende Maßnahmen ergriffen beziehungsweise eingeleitet werden, wenn genügend Zeit bis zum Beginn der Krebstherapie bleibt.
Welche Art der vorbeugenden Maßnahme bei dem einzelnen Patienten in Frage kommt, hängt von Erkrankung, geplanter Therapie und, in besonderem Maße, von seinem Alter und Pubertätsstatus ab. Einem Jungen während oder nach der Pubertät stehen zum Teil andere Möglichkeiten zur Verfügung als einem Jungen vor Eintritt der Pubertät [LAN2025]. Einige der derzeit durchgeführten fruchtbarkeitserhaltenden Maßnahmen bei Jungen und jungen Männern werden im Anschluss kurz erläutert.
Gewinnung von Samenzellen
bei Jungen während und nach der Pubertät
Bei Jungen, deren Hoden bereits mit der Samenzellbildung begonnen haben, können vor der Krebstherapie Spermien gewonnen und für eine spätere künstliche Befruchtung eingefroren werden (Kryokonservierung). Die Samenzellproduktion beginnt in der Pubertät im Alter von durchschnittlich 13 bis 14 Jahren und geht mit der Entwicklung der äußeren Geschlechtsmerkmale einher (zum Beispiel Hodenwachstum mit einem Hodenvolumen ab 8 Milliliter, Längenwachstum des Penis, kräftigere Schambehaarung).
Die Gewinnung von Samenzellen kann auf unterschiedliche Weise erfolgen, zum Beispiel:
- durch Ejakulation: Am einfachsten lassen sich Spermien aus der Samenflüssigkeit nach Auslösen eines Samenergusses (Ejakulation) gewinnen. Da diese Methode ohne jedes Gesundheitsrisiko anwendbar ist, kann sie auch dann vor einer Krebstherapie erwogen werden, wenn das Risiko für eine Fruchtbarkeitsschädigung nur gering ist.
- durch eine Hodenbiopsie: Wenn im Samenerguss keine verwertbaren Samenzellen zu finden sind, kann eine Gewebeprobe aus dem Hoden entnommen werden (Biopsie). Dazu ist eine kurze Narkose erforderlich.
Die eingefrorenen Samenzellen können jahrelang gelagert und dann aufgetaut werden, wenn der ehemalige Patient einen Kinderwunsch hat und eine Schwangerschaft auf natürlichem Wege nicht möglich ist. Bei einer Kryokonservierung von Hodengewebe ist allerdings zu beachten, dass – aufgrund der geringeren Spermienzahl – bei einer späteren künstlichen Befruchtung auch die Fruchtbarkeit der Frau eine wichtige Rolle für das Eintreten einer Schwangerschaft spielt.
bei Jungen vor der Pubertät
Da die Hodenfunktion und somit die Bildung von Samenzellen erst mit der Pubertätbeginnen, stehen bei Jungen vor der Geschlechtsreife noch keine reifen Samenzellen zur Verfügung. In diesem Fall besteht vor einer Chemo- oder Strahlentherapie nur die Möglichkeit, unreifes Hodengewebe durch einen operativen Eingriff (Hodenbiopsie) zu entnehmen und einzufrieren. Dieses Hodengewebe enthält die Stammzellen, aus denen sich normalerweise nach Eintritt der Geschlechtsreife funktionsfähige Samenzellen entwickeln.
Die Methode befindet sich derzeit allerdings noch in der Erprobung, ist also rein experimentell, und die Kryokonservierung von Hodengewebe kann nur im Rahmen von Studien und an bestimmten Zentren durchgeführt werden (mehr dazu siehe Androprotect®, Netzwerk zu Erhaltung der Fruchtbarkeit). Bei Menschen war es bislang noch nicht möglich (unter anderem weil das Verfahren noch relativ neu ist), aus unreifem Hodengewebe nach Kryokonservierung und späterer Rücktransplantation eine Spermienreifung anzustoßen. (Beim Menschenaffen allerdings ist dies bereits gelungen und ein Baby auf diese Weise geboren).
Auch besteht das denkbare Risiko, dass die Gonaden von der Krebserkrankung (Metastasierung) betroffen sind und es so nach späterer Rücktransplantation von Hodengewebe zu einem Rückfall kommen könnte. Vor allem bei systemischen Erkrankungen wie der Leukämie ist dieses Risiko sehr hoch, zwei Drittel der Patienten haben Leukämiezellen in den Keimdrüsen. Auch bei soliden Tumoren kann ein Befall der Keimdrüsen vorliegen.
Gut zu wissen: Nicht bei allen Patienten sind vorbeugende Maßnahmen angezeigt. Betroffene können gemeinsam mit dem Behandlungsteam vorab besprechen, wie groß das krankheits-/therapiebedingte Risiko für eine Unfruchtbarkeit ist und welche Angebote in der jeweiligen Situation zur Verfügung stehen beziehungsweise sinnvoll sind.
Behandlung von Fruchtbarkeitsstörungen und Hormonmangel nach der Therapie
Welche Behandlung bei einer Fruchtbarkeitsstörung in Frage kommt, hängt vor allem davon ab, zu welchem Zeitpunkt der Geschlechtsentwicklung (vor oder nach der Pubertät) die Störung auftritt, welche Art der Beeinträchtigung vorliegt, auf welcher Ursache sie beruht und welches Ziel mit der Behandlung verfolgt werden soll. Sind beispielsweise die Hoden direkt geschädigt, ist in manchen Fällen nur eine Behandlung von Symptomen möglich, zum Beispiel eine Hormonersatztherapie mit Testosteron, um Beschwerden vorzubeugen. Bei einer ausschließlichen Beeinträchtigung der übergeordneten Steuerungszentralen (Hypothalamus, Hypophyse) kann es dagegen möglich sein, durch Verabreichung entsprechender Hormone die Fruchtbarkeit des Patienten wiederherzustellen.
Im Folgenden erhalten Sie Informationen zu verschiedenen Möglichkeiten der Hormontherapie sowie der künstlichen Befruchtung.
Hormonersatztherapie
Welche Art der Hormonersatztherapie für den einzelnen Patienten in Frage kommt, richtet sich zunächst nach der Art der Störung und deren Ursache. Darüber hinaus spielen Ziel und Zweck der Behandlung eine Rolle.
Hormontherapie bei ausbleibender oder verzögerter Pubertätsentwicklung (Pubertas tarda)
Eine Krebstherapie kann dazu führen, dass die Geschlechtshormone ausfallen, die für die Einleitung der Pubertätsentwicklung verantwortlich sind. Ob es sich dabei primär um einen Ausfall übergeordneter Hormone (Hypothalamus-, Hypophysenhormone) handelt, die wiederum die Produktion der männlichen Geschlechtshormone in den Hoden beeinträchtigen, oder ob die Hodenfunktion direkt gestört ist, hängt von der Art der Behandlung (Schädelbestrahlung, Chemotherapie, Bestrahlung im Bauch- oder Beckenbereich) und vom Ort der Organschädigung ab.
Die Ursache für die Störung ist ausschlaggebend dafür, welche Art der Behandlung in Frage kommt.
- Therapie bei beeinträchtigter Funktion von Hypothalamus/Hypophyse: Durch eine Schädelbestrahlung oder einen Hirntumor kann es zu einer verminderten Ausschüttung der Hormone LH und FSH kommen. Dadurch werden weder die Testosteron- noch die Spermienbildung in den Hoden angeregt, die Pubertätsentwicklung kommt nicht in Gang beziehungsweise zum Abschluss. Betroffene Jungen ab dem 13.bis 14. Lebensjahr erhalten zunächst eine Behandlung mit LH und FSH. Ziel ist, die Samenzellbildung und die Geschlechtsentwicklung einzuleiten / zu stimulieren. Wenn das Hodenwachstum abgeschlossen und die männlichen Geschlechtsmerkmale vollständig entwickelt sind, wird die FSH-/LH-Hormontherapie (die teuer und aufwändig ist) durch eine Hormonersatztherapie mit Testosteron ersetzt, bis ein Kinderwunsch besteht (siehe Abschnitt zu Behandlung bei Kinderwunsch).
- Therapie bei Schädigung der Hoden: Eine Bestrahlung im Becken- oder Leistenbereich kann die Zellen, die für die Spermienbildung und/oder Testosteronproduktion zuständig sind, direkt schädigen – wobei die Sertoli-Zellen, die für die Spermienbildung zuständig sind, wesentlich empfindlicher sind als die Leydig-Zellen, die für die Testosteronproduktion zuständig sind. Im Falle einer solchen Schädigung ist eine Hodenstimulation durch die Gabe übergeordneter Geschlechtshormone nicht möglich. Im Rahmen der Behandlung wird daher nur das fehlende Testosteron ersetzt, welches in der Pubertät entscheidend ist für die Entwicklung der männlichen Geschlechtsorgane und -merkmale (siehe auch Abschnitt zu Testosteronbehandlung). Vor Therapiebeginn können Samenzellen/Hodengewebe gewonnen und eingefroren werden, um möglicherweise später einen Kinderwunsch zu erfüllen. Die Wirksamkeit der Hormontherapie wird durch regelmäßige Untersuchungen (zum Beispiel körperliche Untersuchung mit Bewertung der Tanner-Stadien, Bestimmung des Knochenalters, Hormonanalysen) überprüft.
Hormontherapie bei vorzeitiger Pubertätsentwicklung (Pubertas praecox) nach Schädelbestrahlung
Die Pubertas praecox wird durch eine Schädigung von Nervenzellen im Gehirn ausgelöst, die dazu führt, dass der Hypothalamus vorzeitig das Hormon GnRH (Gonadotropin- Releasing Hormon) ausschüttet und somit die Pubertätsentwicklung – über die Stimulation der Hypophysenhormone FSH und LH und folglich der Hormone des Hodengewebes – in Gang setzt (siehe Regelkreis der Sexualhormone in Kapitel „Fortpflanzungsorgane und Fruchtbarkeit“).
Eine verfrühte, nicht altersgemäße körperliche Entwicklung stellt für die betroffenen Kinder eine große psychosoziale Belastung dar. Darüber hinaus kommt es, wenn keine Behandlung erfolgt, zu einem beschleunigten Knochenwachstum. Dies geht zunächst mit einem schnellen Längenwachstum einher, führt später aber, durch die zu frühe und zu schnelle Knochenreifung, zu einem vorzeitigen Wachstumsstopp. Da die Wachstumsphase dadurch insgesamt verkürzt ist, kann Kleinwuchs die Folge sein. Die behandelnden Ärzte sind daher bestrebt, eine vorzeitige Pubertätsentwicklung schnellstmöglich zu stoppen.
Die Behandlung erfolgt mit so genannten GnRH-Analoga, das sind Substanzen, die dem Hormon des Hypothalamus ähnlich sind. Die langfristige, regelmäßige Gabe dieser Hormonpräparate verhindert, dass der Kreislauf der Geschlechtshormone in Gang kommt. Die Hormone werden alle vier Wochen (als Monats-Depot) unter die Haut oder in einen Muskel gespritzt. Regelmäßige Untersuchungen (zum Beispiel körperliche Untersuchung mit Bewertung der Tanner-Stadien; gelegentliche Bestimmung des Knochenalters) dienen dazu, die Wirksamkeit der Hormontherapie zu überprüfen. Die Dauer der Behandlung wird so lange fortgesetzt, bis der Zeitpunkt des normalen Pubertätsbeginns erreicht ist.
Hormontherapie bei Testosteronmangel nach der Pubertät
Bei einer Hodenoperation oder einer Bestrahlung der Hoden mit einer Dosis von über 20 Gray können die Zellen, die für die Bildung von Testosteron verantwortlich sind (Leydigzellen), entfernt beziehungsweise geschädigt werden. Auch eine fehlende Stimulation dieser Zellen infolge einer Funktionsstörung der Hormondrüsen im Gehirn ist möglich. Daraus kann ein Mangel an Testosteron resultieren, der sich unter anderem negativ auf das Sexualleben, den Stoffwechsel und das Wohlbefinden des Betroffenen generell auswirken kann (siehe auch Kapitel „Fortpflanzungsorgane und Fruchtbarkeit“, Abschnitt Testosteronproduktion).
Um den Folgen eines solchen Hormonmangels entgegenzuwirken, muss das fehlende Testosteron ersetzt werden. Das Ersatzhormon steht in Form von Tabletten, Pflastern oder Hautgelen zur Verfügung, kann aber auch als langwirkende Injektion verabreicht werden. Die Wirksamkeit der Testosteronbehandlung wird in regelmäßigen Abständen durch die Kontrolle der Hormonwerte und durch körperliche Untersuchungen überprüft. Im Falle eines Kinderwunsches kann bei Betroffenen, deren Hodenfunktion intakt ist, eine Hormonersatztherapie mit FSH und LH eingeleitet werden (siehe unten).
Wichtig: Bei einer dauerhaft eingeschränkten Störung der Testosteronproduktion sollte die Hormonersatztherapie gegebenenfalls lebenslang erfolgen. Die Behandlung dient der Symptombehandlung, das heißt, sie hat keinen Einfluss auf die Samenzellreifung beziehungsweise die Fruchtbarkeit des Betroffenen.
Hormontherapie bei Kinderwunsch (im Falle einer Schädigung von Hypothalamus / Hypophyse)
Eine Schädelbestrahlung, die den Hypothalamus und/oder die Hypophyse mit einbezieht und eine Dosis von 30 Gray überschreitet, kann zu einer verminderten Ausschüttung der Hormone LH und FSH führen. Dadurch wird die Stimulation des Hodens herabgesetzt und es werden weniger oder keine Samenzellen gebildet (Oligozoospermie / Azoospermie).
Wenn ein konkreter Kinderwunsch besteht, kann eine Hormonersatztherapie mit LH und FSH erfolgen, um die Spermienbildung in den Hoden anzuregen (siehe Regelkreis der Sexualhormone in Kapitel „Fortpflanzungsorgane und Fruchtbarkeit“). Solange kein Kinderwunsch besteht, wird lediglich das fehlende Testosteron ersetzt, um den Folgen eines Testosteronmangels entgegenzuwirken (siehe Abschnitt zur Behandlung von Testosteronmangel oben).
Wichtig: Bei einer behandlungsbedingten Schädigung des Hodens selbst kommt eine Behandlung mit den Hypophysenhormonen LH und FSH nicht in Frage, da dies nichts an der gestörten Samenzellproduktion / der eingeschränkten Fruchtbarkeit ändern würde.
Assistierte oder künstliche Befruchtung mittels zuvor gewonnener Samenzellen
Eine assisitierte oder künstliche Befruchtung wird nur dann in Erwägung gezogen, wenn eine Schwangerschaft auf natürlichem Wege nicht möglich ist.
Assistierte Befruchtung
Bei einer assistierten Befruchtung werden Samenzellen im Labor vorab im Hinblick auf ihre Funktionstüchtigkeit ausgewählt und dann, während der fruchtbaren Tage der Frau, mit Hilfe eines kleinen Schlauches direkt in die Gebärmutterhöhle eingebracht. Das Verfahren wird „Intrauterine Insemination“ (IUI) genannt und kann zum Beispiel dann in Frage kommen, wenn die Zahl funktionstüchtiger Samenzellen nur geringfügig vermindert ist (Oligospermie).
Ein Vorteil gegenüber der natürlichen Befruchtung ist, dass die Samenzellen durch die Übertragung den eventuell befruchtungsfähigen Eizellen näher sind. Außerdem durchlaufen die Samenzellen bereits im Labor einen Reifungsprozess, der sonst erst in den weiblichen Geschlechtsorganen stattfindet.
Künstliche Befruchtung
Bei einer künstlichen Befruchtung werden Eizellen außerhalb des weiblichen Körpers mit Samenzellen des Mannes befruchtet. Verschiedene Methoden stehen dafür zur Verfügung:
- In-vitro-Fertilisation (IVF): Bei diesem Verfahren werden Samenzellen zur Befruchtung mehrerer Eizellen in ein Reagenzglas gegeben. Die Samenzellen finden selbst den Weg zu den und in die Eizellen. Die befruchteten Eizellen werden anschließend in die vorbereitete Gebärmutter eingebracht.
- Intracytoplasmatische Spermieninjektion (ICSI): Bei dieser Methode wird unter einem speziellen Mikroskop eine einzelne Samenzelle direkt in eine Eizelle injiziert. Die auf diese Weise befruchteten Eizellen werden anschließend in die Gebärmutterschleimhaut eingebracht.
Welches der genannten Verfahren am sinnvollsten ist, hängt vor allem von der Menge der zu Verfügung stehenden Samenzellen ab. Das erste Verfahren (Insemination) erfordert mehr Spermien als die beiden anderen. Darüber hinaus spielt auch die Beweglichkeit der Samenzellen eine Rolle.
Für die assistierte oder künstliche Befruchtung können vor der Behandlung entnommene, eingefrorene Spermien (aus Samenerguss oder Hodengewebe) verwendet werden, sofern vor der Krebstherapie bereits eine solche Samenzellentnahme möglich war (siehe Abschnitt „Vorbeugende Maßnahmen zum Erhalt der Fruchtbarkeit vor der Therapie“). Aber auch nach einer Chemo- und/oder Strahlentherapie können bei wiederholt nachgewiesenem Fehlen von lebenden Samenzellen im Samenerguss durch eine Hodenbiopsie in vielen Fällen einzelne lebende Spermien für eine (spätere) künstliche Befruchtung gewonnen werden.
Weitere Informationen
zum Thema Fruchtbarkeit nach Krebstherapie finden Sie auf der Webseite www.fertiprotekt.de. Die Seite bietet, neben allgemeinen Patienteninhalten, auch speziell Seiten zum Thema "Krebserkrankungen im Kindesalter". Darüber hinaus erhalten Sie dort Kontaktdaten von Zentren und Experten für Diagnose und Therapie von Fruchtbarkeitsstörungen sowie von Experten der Reproduktionsmedizin zur Kinderwunschbehandlung nach Krebstherapie.
Bitte beachten Sie, dass fruchtbarkeitserhaltende Maßnahmen mit Kosten verbunden sein können, die die Betroffenen zum Teil selbst tragen müssen. Gemäß einer Richtlinie des Gemeinsamen Bundesausschusses (G-BA) vom 16. Juli 2020 übernehmen die gesetzlichen Krankenkassen inzwischen unter bestimmten Voraussetzungen die Kosten für das Einfrieren von Ei- und Samenzellen und die dazugehörigen medizinischen Maßnahmen; mehr dazu siehe Pressemitteilung zum Thema. Weitere Informationen zu Kosten fertilitätserhaltender Maßnahmen beziehungsweise einer späteren künstlichen Befruchtung erhalten Sie bei www.fertiprotekt.de.
 Infoblatt zum Thema Fruchtbarkeit bei Jungen (281KB)
Infoblatt zum Thema Fruchtbarkeit bei Jungen (281KB)
herausgegeben von der Studiengruppe "Fertilität nach Chemo-und Strahlentherapie im Kindes-und Jugendalter, FeCt" an der Klinik für Pädiatrie mit Schwerpunkt Onkologie und Hämatologie - Charité, Universitätsmedizin Berlin
 Informationbroschüre zum Thema Fruchtbarkeit für jugendliche Patienten mit einer Krebserkrankung (2.0 MB)
Informationbroschüre zum Thema Fruchtbarkeit für jugendliche Patienten mit einer Krebserkrankung (2.0 MB)
Autor: Idee für Text und Video © Anja Borgmann-Staudt, Arbeitsgruppe FeCt, in Zusammenarbeit mit Mitgliedern der Netzwerke FertiPROTEKT, PanCare und der Therapieoptimierungsstudien der Fachgesellschaft für pädiatrische Onkologie und Hämatologie. Videorealisation Helmut Schmidt, Koordinator Film- und Dreharbeiten Charité CFM Berlin
 New leaflet: Fertility in boys after chemo- and radiotherapy (243KB)
New leaflet: Fertility in boys after chemo- and radiotherapy (243KB)
Englischsprachige Version des Infoblatts zum Thema Fruchtbarkeit bei Jungen. Brief guide by Anja-Borgmann-Staudt, published by the Berliner Krebsgesellschaft.
 Information for boys and young men with cancer, their parents, carers and doctors. (2.0 MB)
Information for boys and young men with cancer, their parents, carers and doctors. (2.0 MB)
Englischsprachige Version der Informationsbroschüre zum Thema Fruchtbarkeit für jugendliche Patienten mit einer Krebserkrankung. Berlin, December 2020, © Anja Borgmann-Staudt, Greta Sommerhäuser and Lucía Alacán Friedrich