Myelodysplastisches Syndrom (MDS) – Kurzinformation
Das myelodysplastische Syndrom, auch MDS genannt, ist eine Erkrankung des blutbildenden Systems. Die Entwicklung zu einer Leukämie ist in fortgeschritten Stadien möglich. In diesem Text erhalten Sie Informationen zum Krankheitsbild, zu Formen der MDS, möglichen Ursachen und Symptomen sowie zu Krankheitsverlauf, Diagnostik, Behandlung und Prognose.
Autor: PD Dr, med Ayami Yoshimi, Redaktion: Maria Yiallouros, Freigabe: Prof. Dr. med. Charlotte Niemeyer, Dr. Miriam Erlacher, Zuletzt geändert: 04.11.2025 https://kinderkrebsinfo.de/doi/e221512
Inhaltsverzeichnis
Krankheitsbild
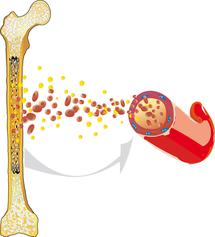
Das myelodysplastische Syndrom (kurz: MDS) umfasst eine Gruppe von Erkrankungen, bei denen das Knochenmark nicht normal funktioniert und infolgedessen nicht ausreichend gesunde Blutzellen produziert werden.
Alle Blutzellen, die im Blut vorkommen – dazu gehören rote Blutkörperchen (Erythrozyten), weiße Blutkörperchen (Leukozyten) und Blutplättchen (Thrombozyten) – entstehen aus blutbildenden Zellen im Knochenmark, den so genannten Blutstammzellen). Bevor aus den Blutstammzellen im Knochenmark funktionsfähige Blutzellen entstehen können, müssen sie zahlreiche Reifungs- und Teilungsprozesse durchlaufen. Fachleute sprechen auch von Hämatopoese. Weitere Informationen zur Blutbildung finden Sie in unserem Patiententext zu Aufbau und Funktion von Knochenmark und Blut.
Bei Patienten mit einem MDS sind diese Prozesse im Knochenmark gestört. Die Zellen reifen fehlerhaft aus, sie sehen auch unter dem Mikroskop anders aus als gesunde Zellen (Dysplasie). Oft gehen diese fehlerhaft gebildeten Zellen schon im Knochenmark zugrunde, so dass von dort aus nicht genügend Blutzellen ins Blut übertreten können. Die Folge davon ist, dass sich im Blut zu wenig gesunde rote und weiße Blutkörperchen sowie Blutplättchen befinden, was wiederum mit verschiedenen gesundheitlichen Problemen wie Blutarmut (Anämie), Infektionen und/oder einer erhöhten Blutungsneigung einhergeht.
Die gestörte Ausreifung der Blutstammzellen führt andererseits zu einer stetigen Zunahme der unreifen Blutzellen (der so genannten Blasten) im Knochenmark. Diese können aufgrund ihrer Unreife ihre vorgesehenen Funktionen nicht erfüllen. Bei einem Teil der MDS-Patienten nimmt im Verlauf der Erkrankung die Zahl der Blasten in Knochenmark und Blut so stark zu, dass das MDS nicht mehr von einer Leukämie unterschieden werden kann. Aus diesem Grund wurde die Erkrankung früher auch als „Präleukämie“ bezeichnet.
Häufigkeit
Das myelodysplastische Syndrom (MDS) ist die häufigste bösartige Erkrankung des Knochenmarks bei älteren Menschen; im Kindes- und Jugendalter tritt es sehr selten auf. Sein Anteil an der Gesamtheit aller Blutkrebserkrankungen beträgt bei Kindern und Jugendlichen unter 18 Jahren etwa 8 %, der Anteil an allen bösartigen Erkrankungen in dieser Altersgruppe etwa 2,4 %.
In Deutschland erkranken nach Angaben des Deutschen Kinderkrebsregisters (Mainz) jährlich circa 56 Patienten im Alter von 0-17 Jahren neu an einem MDS. Das mittlere Erkrankungsalter liegt bei etwa 9 Jahren. Jungen sind etwas häufiger betroffen als Mädchen (Geschlechterverhältnis: 1,3 : 1).
Formen des Myelodysplastischen Syndroms (MDS)
Je nach Art der Entstehung eines myelodysplastischen Syndroms (MDS) sowie auf der Basis mikroskopischer Untersuchungen von Blut und Knochenmark werden verschiedene MDS-Formen unterschieden, die im Anschluss vorgestellt werden.
Primäres und sekundäres MDS
Das myelodysplastische Syndrom (MDS) entsteht häufig ohne ersichtlichen Grund. Es wird als „primäres“ MDS bezeichnet. Etwa 75 % der Kinder mit einem MDS gehören in diese Gruppe. Es wird allerdings angenommen, dass auch bei einem primären MDS im Kindesalter angeborene genetische Veränderungen vorliegen können, die bisher noch nicht identifiziert wurden (siehe auch Kapitel "Ursachen“).
Bei einem Teil der Patienten kann die Entstehung eines MDS mit bestimmten Auslösern in Verbindung gebracht werden; in diesen Fällen spricht man von einem „sekundären“ MDS. Manche Patienten erkranken zum Beispiel nach vorangegangener Behandlung mit einer Strahlentherapie oder Chemotherapie, die aufgrund einer anderen, meist bösartigen Erkrankung durchgeführt wurde. Andere Patienten leiden vor der Diagnose eines MDS bereits an einer angeborenen Erkrankung, die mit einer Störung der Knochenmarkfunktion einhergeht. Dazu gehören zum Beispiel die Fanconi-Anämie, die Dyskeratosis congenita, das Shwachman-Diamond-Syndrom, die Diamond-Blackfan-Anämie (DBA) oder eine schwere angeborene Neutropenie. Auch eine erworbene aplastische Anämie (SAA) kann der Diagnose eine MDS vorausgehen.
Untertypen des primären MDS im Kindesalter nach WHO-Klassifikation
Das primäre MDS bei Kindern wird nach der Klassifikation der Weltgesundheitsorganisation (englisch World Health Organization, WHO), der WHO-Klassifikation, in zwei Unterformen (Subtypen) eingeteilt. Diese Einteilung berücksichtigt hauptsächlich den Anteil der unreifen Zellen (Blasten) im Blut und im Knochenmark.
Refraktäre Zytopenie des Kindesalters (RCC)
Bei Patienten mit einer „refraktären Zytopenie des Kindesalters“ (RCC) ist der (Blasten)anteil mit unter 2 % im Blut und unter 5 % im Knochenmark im Vergleich zu gesunden Kindern nicht deutlich erhöht. Sehr häufig ist aber das Knochenmark bei Kindern mit RCC auffallend zellarm, das heißt, alle Zellen, die normalerweise im Knochenmark vorhanden sind (rote Blutzellen, weiße Blutzellen, Blutplättchen), liegen in reduzierter Zahl vor. Deswegen muss im Rahmen der so genannten Differentialdiagnose immer abgeklärt werden, ob eine andere angeborene Erkrankung des Knochenmarks (Knochenmarkversagen) oder eine aplastische Anämie vorliegen könnte, denn auch bei diesen Krankheiten ist ein zellarmes Knochenmark die Regel.
Myelodysplastisches Syndrom mit Blastenexzess (MDS-EB)
Bei MDS-Patienten kann der Anteil der Blasten in Blut und Knochenmark deutlich über 2 % beziehungsweise 5 % ansteigen. Dieser MDS-Typ wird als MDS-EB, also MDS mit Blastenexzess (englisch „excess of blasts“, EB), bezeichnet. Der Blastenanteil sollte allerdings 29 % im Knochenmark nicht übersteigen, denn in diesem Fall spricht man von einer Leukämie. Da bei der Unterscheidung von MDS und Leukämie aber auch andere Gesichtspunkte berücksichtigt werden, zum Beispiel die Geschwindigkeit, mit der die Blastenzahl zunimmt, ist die Unterscheidung (Differenzialdiagnose) zwischen MDS-EB und Leukämie manchmal schwierig. In Grenzfällen, das heißt, bei einer Blastenzahl zwischen 20 und 30 %, ist es sinnvoll, die Diagnostik (in Form einer Knochenmarkpunktion) nach zwei Wochen zu wiederholen, um die Diagnose zu sichern.
|
MDS-Subtyp |
Blut |
Knochenmark |
|---|---|---|
|
Refraktäre Zytopenie des Kindesalters (RCC) |
weniger als 2 % Blasten |
weniger als 5 % Blasten |
|
Myelodysplastisches Syndrom mit Blastenexzess (MDS-EB) |
2 – 29 % Blasten |
5 – 29 % Blasten |
Ursachen
Die genauen Ursachen für ein myelodysplastisches Syndrom (MDS) bleiben meist ungeklärt; die Erkrankung ist aber – ebenso wie andere Krebsformen – weder ansteckend noch kann sie auf andere Menschen übertragen werden. In den meisten Fällen entsteht ein MDS bei zuvor gesunden Kindern und Jugendlichen ohne ersichtlichen Grund (so genanntes „primäres MDS“). Man geht aber insgesamt davon aus, dass die Betroffenen eine besondere Empfindlichkeit (Veranlagung) für die Entwicklung eines MDS beziehungsweise einer Leukämie aufweisen. Diese Veranlagung bezeichnet man auch als "Prädisposition".
Ursache der Prädisposition sind Genveränderungen (Mutationen), die auch in den Samen- oder Eizellen (also in der Keimbahn) vorliegen und dadurch vererbt werden können. Die Genveränderung liegt in diesem Fall auch in allen Körperzellen des Patienten vor. Die betroffenen Kinder und Jugendlichen haben diese Keimbahnmutation entweder von einem oder beiden Elternteilen vererbt bekommen, oder aber die Genveränderung des Erkrankten ist in der befruchteten Eizelle neu entstanden.
Es ist schon seit vielen Jahren bekannt, dass Genveränderungen, die angeborene Störungen der Blutbildung im Knochenmark verursachen können (wie die Fanconi-Anämie, die schwere angeborene Neutropenie, Dyskeratosis congenita oder Diamond-Blackfan-Anämie), auch mit einer Veranlagung für das Auftreten eines MDS einhergehen. In den letzten Jahren wurden weitere erbliche Erkrankungen entdeckt, die hier eine Rolle spielen. Dazu gehört die so genannte GATA2-Defizienz oder das SAMD9/SAMD9-Syndrom. Da diese angeborenen Erkrankungen in der Regel mit einem erhöhten Krebsrisiko einhergehen, werden sie auch als Krebsprädispositionssyndrome bezeichnet.
Bei älteren Menschen verläuft die Entwicklung eines MDS anders. In den meisten Fällen liegen bei Erwachsenen keine angeborenen Störungen, sondern über die Jahrzehnte erworbene Genveränderungen vor, die eine Zelle langsam zur MDS- oder Leukämiezelle werden lassen. Einige Patienten haben vor der Diagnose eines MDS eine Strahlentherapie oder Chemotherapie als Behandlung für eine andere Krebserkrankung erhalten. Das MDS ist dann die Zweiterkrankung (sekundäres MDS), die zumindest zum Teil durch die Behandlung der ersten Krebserkrankung ausgelöst wurde.
Krankheitszeichen
Die Krankheitszeichen (Symptome), die bei einem Patienten mit myelodysplastischem Syndrom (MDS) auftreten können, richten sich vor allem danach, wie stark der Mangel an (funktionstüchtigen) Blutzellen ausgeprägt ist, das heißt, nach dem Grad der Zytopenie. Je nachdem, welche Zellen des Blutes betroffen sind, lassen sich folgende Formen der Zytopenie und, damit einhergehend, folgende Symptome unterscheiden:
Blutarmut: Mangel an roten Blutkörperchen (Anämie)
Die Aufgabe der roten Blutzellen (Erythrozyten) ist es, den Sauerstoff, der beim Einatmen über die Lunge aufgenommen wird, zu den verschiedenen Organen und Geweben des Körpers zu transportieren. Ein Mangel an roten Blutkörperchen (Anämie) führt zu Krankheitszeichen wie Blässe, Müdigkeit, Schwäche und Kopfschmerzen.
Abwehrschwäche: Mangel an weißen Blutzellen (Leukopenie/Neutropenie)
Weiße Blutkörperchen (Leukozyten) sind für die Abwehr von Krankheitserregern und somit für die Vermeidung von Infektionen verantwortlich. Es gibt verschiedene Arten von Leukozyten, zum Beispiel Lymphozyten und Granulozyten, die unterschiedliche Aufgaben bei der Immunabwehr wahrnehmen. Durch den Mangel an funktionstüchtigen weißen Blutkörperchen, der so genannten Leukopenie, ist der Körper infektgefährdet. Bei Patienten mit einem MDS ist häufig in besonderem Maße die Zahl der Granulozyten vermindert (so genannte Granulozytopenie oder Neutropenie). Da diese für die Abwehr von Bakterien und Pilzen zuständig sind, treten bei MDS-Patienten insbesondere Bakterien- und PilzInfektionen auf, die sich vor allem durch Fieber bemerkbar machen.
Blutungsneigung: Mangel an Blutplättchen (Thrombozytopenie)
Blutplättchen (Thrombozyten) spielen eine wichtige Rolle bei der Blutgerinnung. Sind sie vermindert (so genannte Thrombozytopenie), kommt es sowohl spontan als auch nach Verletzungen schneller zu Blutungen. Diese äußern sich zum Beispiel durch punktförmige Haut- oder Schleimhautblutungen (Petechien), blaue Flecken (Hämatome) und/oder Nasen-/Zahnfleischbluten, aber auch schwerwiegende Blutungen der inneren Organe oder des Gehirns kommen vor. Das Risiko für schwere Blutungen ist umso höher, je ausgeprägter die Thrombozytopenie, das heißt, je größer der Mangel an Thrombozyten ist.
Bei Patienten mit einem MDS mit Blastenexzess (MDS-EB) (siehe auch Abschnitt "Formen des MDS“) können schwer zu behandelnde Begleiterscheinungen auftreten, zum Beispiel eine Entzündung kleiner Blutgefäße oder das so genannte Sweet-Syndrom, das mit Fieber und roter Knötchenbildung auf der Haut einhergeht.
Diagnose
Findet der (Kinder-)Arzt durch Krankheitsgeschichte (Anamnese) und körperliche Untersuchung des Patienten Hinweise auf eine Bluterkrankung, wird er zunächst eine umfassende Blutuntersuchung vornehmen. Wenn sich, durch bestimmte Veränderungen im Blutbild, der Verdacht auf eine Blutkrankheit wie das das myelodysplastische Syndrom (MDS) erhärtet, ist eine Entnahme von Knochenmark zur Sicherung der Diagnose notwendig. Zu diesem Zweck und für eventuell sich anschließende Untersuchungen wird der Arzt den Patienten in ein Krankenhaus überweisen, das auf Krebs- und Bluterkrankungen bei Kindern und Jugendlichen spezialisiert ist (Klinik für pädiatrische Onkologie/Hämatologie).
Untersuchung von Blut und Knochenmark
Da die Symptome bei MDS-Patienten nicht spezifisch auf ein MDS hinweisen und auch bei anderen Bluterkrankungen wie Leukämien auftreten, kann die Diagnose dieser Erkrankung nur durch eine umfassende Untersuchung des Blutes und des Knochenmarks gestellt werden.
Für die eindeutige Diagnosestellung des MDS wird Knochenmark benötigt, das aus dem Beckenknochen entnommen wird. Dafür sind eine Knochenmarkaspiration (Knochenmarkpunktion) und eine Knochenmarkstanzbiopsie notwendig. Beide Methoden ergänzen sich und werden im Rahmen einer gemeinsamen Untersuchung durchgeführt. Bei der Knochenmarkaspiration wird der Knochen mittels einer speziellen Hohlnadel punktiert und eine kleine Menge Knochenmarkblut angesaugt („aspiriert“). Bei der Knochenmarkstanzbiopsie wird ein kleines Stück des Beckenknochens (circa 1 mm Durchmesser) mittels einer Hohlnadel entnommen. Weitere, allgemeine Informationen zu Knochenmarkpunktion und -stanzbiopsie finden Sie hier.
Nach Gewinnung der Probe wird unter dem Mikroskop das Aussehen der blutbildenden Zellen im Knochenmark durch einen Spezialisten für Blut- und Krebserkrankungen beurteilt. Bei einem MDS sind verschiedene Veränderungen des Aussehens der Zellen (Dysplasie) möglich, die für die Diagnose entscheidend sind. Bei einem Myelodysplastischen Syndrom mit Blastenexzess (MDS-EB) ist die Zahl der Blasten im Knochenmark erhöht (siehe Kapitel „Formen des MDS“). Am Material aus dem Knochenmarkaspirat wird zusätzlich eine Untersuchung der Chromosomen (Zytogenetik) durchgeführt (siehe unten). Bei Verdacht auf das Vorliegen eines MDS sollten die Knochenmarkpunktion und die Knochenmarkstanzbiopsie nach circa 14 Tagen wiederholt werden, um eine sichere Diagnosestellung zu gewährleisten.
Untersuchungen der Chromosomen (Zytogenetik)
Veränderungen der Chromosomen in Knochenmark und Blutzellen können bei mehr als der Hälfte der Patienten mit einem MDS mit Blastenexzess (MDS-EB) und bei etwa 30 % der Kinder mit einer refraktären Zytopenie (RCC) festgestellt werden. Der Nachweis dieser Veränderungen hilft bei der Bestätigung der Diagnose eines MDS. Die häufigste und eine typische Chromosomenveränderung bei Kindern mit MDS ist der Verlust eines Chromosoms 7 (so genannte Monosomie 7). In diesen Fällen liegt das Chromosom 7 nur einmal anstatt zweimal in den Zellen vor.
Molekulargenetische Untersuchungen
Einige Kinder und Jugendliche mit einem MDS haben eine genetisch bedingte Empfindlichkeit (Prädisposition) für die Erkrankung, das heißt, bei ihnen liegt eine Keimbahnmutation vor (siehe Kapitel „Ursachen“). Für die Analyse dieser genetischen Veränderungen müssen neben Blut und/oder Knochenmark auch andere Körpergewebe wie zum Beispiel Haarwurzelzellen (Keimbahnmaterial) mit Hilfe molekulargenetischer Methoden untersucht werden. Wird bei einem Patienten mit MDS eine Keimbahnmutation nachgewiesen, so muss im Falle einer geplanten Stammzelltransplantation (SZT) auch ein möglicherweise passender Familienspender auf diese Mutation hin untersucht werden. Nur wenn beim Familienmitglied die Mutation nicht nachweisbar ist, sollte es Stammzellen spenden.
Therapie
Die Behandlung von Patienten mit myelodysplastischem Syndrom (MDS) richtet sich danach, welche Form der Erkrankung vorliegt, das heißt, ob es sich um ein primäres oder sekundäres MDS handelt beziehungsweise, im ersteren Fall, um eine refraktäre Zytopenie des Kindesalters (RCC) oder ein MDS mit Blastenexzess (MDS-EB) (siehe Abschnitt “Formen des MDS“). Zur Behandlung stehen grundsätzlich folgende Therapiemaßnahmen zur Verfügung:
- Transplantation von blutbildenden Stammzellen eines Spenders (allogene Stammzelltransplantation, SZT) nach Konditionierungsbehandlung (Hochdosis-Chemotherapie)
- immunsuppressive Therapie (IST)
- andere medikamentöse Therapien: Chemotherapie, Wirkstoff Azacitidin
- unterstützende Therapien (Supportivtherapie): Transfusionen, Behandlung mit Antibiotika
Im Folgenden wird die Behandlung der Patienten mit verschiedenen MDS-Formen vorgestellt.
Refraktäre Zytopenie des Kindesalters (RCC)
Patienten mit einer refraktären Zytopenie des Kindesalters (RCC) werden – abhängig vom Vorliegen oder Nicht-Vorliegen von Chromosomenveränderungen in Blut- und Knochenmarkzellen, vom Ausmaß der Zellarmut im Blut (Zytopenie) und vom Zellgehalt (Zellularität) des Knochenmarks – unterschiedlich behandelt.
Bei RCC-Patienten, die im Rahmen der Chromosomenanalyse von Knochenmarkzellen den Verlust eines Chromosoms 7 (Monosomie 7 zeigen, ist ein ungünstiger Krankheitsverlauf mit dem Risiko einer Blastenvermehrung innerhalb von ein bis zwei Jahren zu erwarten. Daher sollten diese Patienten baldmöglichst eine allogene Stammzelltransplantation (SZT) erhalten. Bei dieser Behandlung werden dem Patienten in einem ersten Schritt, der so genannten Konditionierung, hohe Dosen an Zytostatika verabreicht (Hochdosis-Chemotherapie), um im Knochenmark alle Zellen (gesund und krank) zu zerstören, das Knochenmark sozusagen zu leeren. Danach werden dem Empfänger gesunde Blutstammzellen aus dem Knochenmark oder dem peripheren Blut eines Spenders verabreicht. Ausführliche Informationen zur Stammzelltransplantation finden Sie hier.
Bei RCC mit normalem Chromosomenbefund kann das Krankheitsbild hingegen über Jahre stabil sein. Wenn diese Patienten keine Bluttransfusionen benötigen und genügend Granulozyten (weiße Blutkörperchen, die Bakterien und Pilze abwehren) besitzen, werden sie zunächst nicht behandelt, sondern lediglich beobachtet und der Krankheitsverlauf mittels regelmäßiger (Blut-)Untersuchungen kontrolliert (so genannte „watch and wait“-Strategie). Verschlechtern sich allerdings die Blutwerte mit der Zeit, kann im Verlauf der Erkrankung doch noch eine Therapie, in der Regel eine Stammzelltransplantation, notwendig werden.
Patienten mit normalem Chromosomenbefund, die schon nach der Diagnosestellung Bluttransfusionen brauchen oder sehr wenige Granulozyten im Blut haben, werden so bald wie möglich mit einer Stammzelltransplantation behandelt. Als Stammzellspender kommen gesunde Geschwister oder passende Fremdspender in Frage. Ist kein passender Geschwisterspender verfügbar, kann bei Patienten mit hypozellulärem Knochenmark auch eine immunsuppressive Therapie (IST) die Therapie der Wahl sein. Diese immunsuppressive Behandlung ähnelt der Behandlung einer schweren aplastischen Anämie [schwere aplastische Anämie, SAA] und zieht sich über mehrere Monate oder Jahre hin.
Durch die immunsuppressive Therapie (IST) kann bei etwa der Hälfte der Patienten ein ausreichender Anstieg der Blutzellzahl erreicht werden, so dass in der Regel keine Bluttransfusionen mehr notwendig sind. Es ist auch möglich, dass nach zunächst erfolgreicher IST wieder eine Zytopenie, also ein Mangel an Blutzellen, entsteht (sogenanntes Rezidiv). Im Falle eines Rezidivs oder bei Nicht-Ansprechen der Erkrankung auf die IST-Therapie wird eine Stammzelltransplantation von einem gut passendem Fremdspender empfohlen.
MDS mit Blastenexzess (MDS-EB)
MDS-Patienten mit einem Blastenexzess (MDS-EB), also einer fortgeschrittenen Form der Ekrankung, haben ein sehr hohes Risiko, im weiteren Verlauf eine Leukämie zu entwickeln. Für ein MDS-EB ist eine frühzeitige Stammzelltransplantation in der Regel die Therapie der Wahl. Als Stammzellspender kommen gesunde Geschwister oder passende Fremdspender in Frage. Bei höheren Blastenzahlen kann die Vorbehandlung mit einer Chemotherapie zur Blastenverminderung vor Konditionierung (Hochdosistherapie) und Stammzelltransplantation sinnvoll sein.
Sekundäres MDS
Patienten mit einem sekundären myelodysplastischen Syndrom (MDS) werden in der Regel wie Patienten mit einem primären MDS mit Blastenexzess (MDS-EB) behandelt. Diese Patienten sollten daher so bald wie möglich nach der Diagnosestellung von einem passenden Stammzellspender transplantiert werden.
Unterstützende (supportive) Therapie während der Behandlung
Für alle Patienten mit einem myelodysplastischen Syndrom (MDS) sind unterstützende Therapiemaßnahmen (Supportivtherapie) sinnvoll und erforderlich. Diese zusätzlichen Therapien tragen dazu bei, krankheitsbedingte Symptome und behandlungsbedingte Nebenwirkungen zu behandeln oder diesen vorzubeugen.
Die meisten Patienten haben zum Zeitpunkt der Diagnose eine Blutarmut (Anämie und/oder einen Mangel an Blutplättchen (Thrombozytopenie), die mit gesundheitlichen Problemen einhergehen (siehe Kapitel „Krankheitszeichen“). Diese Probleme können durch Bluttransfusionen (Gabe von roten Blutzellen beziehungsweise Blutplättchen) behandelt werden. Allerdings wird bei wiederholten Transfusionen von roten Blutzellen dem Körper eine große Menge von Eisen zugeführt, das sich im Lauf der Zeit in Organen (vor allem der Leber und dem Herzen) ablagert und diese schädigen kann (so genannte Eisenüberladung). Bei Patienten mit Eisenüberladung muss daher eine Eisenentzugstherapie durchgeführt werden. Weitere Informationen zum Thema finden Sie in unserem Partnerportal www.kinderblutkrankheiten.de im Patiententext zur "Sekundären Eisenüberladung".
Durch das MDS selbst, aber auch durch dessen Behandlung, zum Beispiel eine Stammzelltransplantation oder eine immunsuppressive Therapie, werden die Patienten hinsichtlich ihrer Immunabwehr geschwächt. Die Patienten müssen daher bestmöglich vor Infektionen geschützt und im Falle eines Infektes schnellstmöglich behandelt werden. Infektionen bei immungeschwächten Kindern sind stets als lebensbedrohlich anzusehen.
Fieber ist oft das erste Anzeichen für eine Infektion. Eltern oder Angehörige von Patienten, bei denen Fieber auftritt, sollten daher umgehend die behandelnde Klinik oder den betreuenden Arzt kontaktieren (auch nachts), damit die Kinder sofort mit Breitspektrumantibiotika (Breitband-Antibiotika behandelt werden können. Bei Patienten mit einem Mangel an Granulozyten (Granulozytopenie, Neutropenie) ist als unterstützende Therapie die vorbeugende Verabreichung von Antibiotika und Antipilzmitteln (Antimykotika) angezeigt.
Prognose
Das myelodysblastische Syndrom (MDS) kann sehr unterschiedlich verlaufen. Es gibt Erkrankungen, die über einen langen Zeitraum stabil sind, andere schreiten rasch fort. Die Prognose für MDS-Patienten wird durch die Art (Subtyp) der Erkrankung (siehe Kapitel "Formen des MDS") und durch das mögliche Vorliegen genetischer Veränderungen in den Knochenmarkzellen bestimmt.
Refraktäre Zytopenie im Kindesalter (RCC)
Patienten mit einer refraktären Zytopenie im Kindesalter (RCC) werden – je nach Vorhanden- oder Nicht-Vorhandensein bestimmter Risikofaktoren – unterschiedlichen Therapiegruppen zugeteilt und erhalten entsprechend unterschiedliche Therapien (Beobachtung, Stammzelltransplantation oder immunsuppressive Therapie (siehe Kapitel „Therapie"). Diese Patienten haben, in allen Therapiegruppen, insgesamt eine gute Prognose mit einer Überlebenswahrscheinlichkeit von 80–90 %. Dies gilt auch für RCC-Patienten mit einer Monosomie 7, die aufgrund des hohen Risikos für ein fortgeschrittenes MDS oder eine Leukämie (Progression) frühzeitig eine allogene Stammzelltransplantation erhalten. Die Prognose mit einer solchen Therapie ist gleich gut wie für andere RCC-Patienten.
Bei einer RCC ist nach erfolgter Stammzelltransplantation das Risiko eines Rückfalls der Erkrankung (Rezidiv) sehr gering. Allerdings stellt jede Stammzelltransplantation eine intensive Therapie dar, bei der das erkrankte Knochenmark nach hochdosierter Chemotherapie durch das gesunde Knochenmark eines Spenders ersetzt wird. Die Patienten sollten daher nach der Stammzelltransplantation lebenslang mindestens einmal im Jahr zur Nachsorgeuntersuchung zu gehen, damit Langzeitnebenwirkungen rechtzeitig erkannt und behandelt werden können.
Auch Patienten, die erfolgreich mit einer immunsuppressiven Therapie (IST) behandelt wurden oder die ohne Therapie beobachtet werden, brauchen eine regelmäßige Kontrolle des Blutbildes und eine jährliche Knochenmarkuntersuchung mit einer Knochenmarkstanzbiopsie und einer Zytogenetik, um einen Rückfall oder ein Fortschreiten der Erkrankung frühzeitig erkennen zu können.
Fortgeschrittenes MDS (MDS-EB) oder sekundäres MDS
Für Kinder und Jugendliche, die an MDS mit Blastenexzess (MDS-EB) oder einem sekundären MDS erkrankt sind, ist eine allogene Stammzelltransplantation die einzige kurative (heilende) Therapiemöglichkeit. Etwa 50 - 60% der Patienten können mit dieser Behandlung geheilt werden. Dabei haben Patienten mit einer schweren Chromosomenveränderung, das heißt, drei oder mehr chromosomalen Veränderungen (auch "komplexer Karyotyp" genannt), eine eher ungünstige Prognose.
 PDF-Datei der Patienten-Kurzinformation zum myelodysplastischen Syndrom (MDS) (321KB)
PDF-Datei der Patienten-Kurzinformation zum myelodysplastischen Syndrom (MDS) (321KB)
Stand: 03.07.2023
Basisliteratur 
- Rudelius M, Weinberg OK, Niemeyer CM, Shimamura A, Calvo KR: The International Consensus Classification (ICC) of hematologic neoplasms with germline predisposition, pediatric myelodysplastic syndrome, and juvenile myelomonocytic leukemia. Virchows Archiv : an international journal of pathology 2023, 482: 113 [PMID: 36445482]
- Bortnick R, Wlodarski M, de Haas V, De Moerloose B, Dworzak M, Hasle H, Masetti R, Starý J, Turkiewicz D, Ussowicz M, Kozyra E, Albert M, Bader P, Bordon V, Cario G, Beier R, Schulte J, Bresters D, Müller I, Pichler H, Sedlacek P, Sauer MG, Zecca M, Göhring G, Yoshimi A, Noellke P, Erlacher M, Locatelli F, Niemeyer CM, Strahm B, for EWOG-MDS: Hematopoietic stem cell transplantation in children and adolescents with GATA2-related myelodysplastic syndrome. Bone marrow transplantation 2021, E-pub ahead of printg [PMID: 34244664]
- Erdmann F, Kaatsch P, Grabow D, Spix C: German Childhood Cancer Registry - Annual Report 2019 (1980-2018). Institute of Medical Biostatistics, Epidemiology and Informatics (IMBEI) at the University Medical Center of the Johannes Gutenberg University Mainz 2020 [URI: https://www.kinderkrebsregister.de/ typo3temp/ secure_downloads/ 42507/ 0/ 1c5976c2ab8af5b6b388149df7182582a4cd6a39/ Buch_DKKR_Jahresbericht_2019_komplett.pdf]
- Niemeyer C, Kratz C: Myelodysplastische Syndrome. in Niemeyer C, Eggert A (Hrsg): Pädiatrische Onkologie und Hämatologie 2018, Springer Verlag; 715 [ISBN: 978-3-662-43685-1]
- Niemeyer C, Eggert A (Hrsg): Pädiatrische Hämatologie und Onkologie. Springer-Verlag GmbH Deutschland 2. vollständig überarbeitete Auflage 2018 [ISBN: 978-3-662-43685-1]
- Ripperger T, Bielack SS, Borkhardt A, Brecht IB, Burkhardt B, Calaminus G, Debatin KM, Deubzer H, Dirksen U, Eckert C, Eggert A, Erlacher M, Fleischhack G, Frühwald MC, Gnekow A, Goehring G, Graf N, Hanenberg H, Hauer J, Hero B, Hettmer S, von Hoff K, Horstmann M, Hoyer J, Illig T, Kaatsch P, Kappler R, Kerl K, Klingebiel T, Kontny U, Kordes U, Körholz D, Koscielniak E, Kramm CM, Kuhlen M, Kulozik AE, Lamottke B, Leuschner I, Lohmann DR, Meinhardt A, Metzler M, Meyer LH, Moser O, Nathrath M, Niemeyer CM, Nustede R, Pajtler KW, Paret C, Rasche M, Reinhardt D, Rieß O, Russo A, Rutkowski S, Schlegelberger B, Schneider D, Schneppenheim R, Schrappe M, Schroeder C, von Schweinitz D, Simon T, Sparber-Sauer M, Spix C, Stanulla M, Steinemann D, Strahm B, Temming P, Thomay K, von Bueren AO, Vorwerk P, Witt O, Wlodarski M, Wössmann W, Zenker M, Zimmermann S, Pfister SM, Kratz CP: Childhood cancer predisposition syndromes-A concise review and recommendations by the Cancer Predisposition Working Group of the Society for Pediatric Oncology and Hematology. American journal of medical genetics. Part A 2017, 173: 1017 [PMID: 28168833]
- Yoshimi A, Strahm B, Baumann I, Furlan I, Schwarz S, Teigler-Schlegel A, Walther JU, Schlegelberger B, Göhring G, Nöllke P, Führer M, Niemeyer CM: Hematopoietic stem cell transplantation in children and young adults with secondary myelodysplastic syndrome and acute myelogenous leukemia after aplastic anemia. Biology of blood and marrow transplantation 2014, 20: 425 [PMID: 24316460]
- Niemeyer C: Myelodysplastic syndrome and aplastic anemia in children. Europ School of Oncology 2000, 31